Julival Ribeiro
Atualizado março - 2022
Introdução
A bacteremia é uma importante complicação de doenças infecciosas e ou se associa ao próprio processo de cuidado, podendo ser dividida em intermitente e contínua.
A bacteremia intermitente se refere à presença de bactérias no sangue por períodos de tempo definidos, seguidos de intervalos não bacterêmicos; normalmente reflete infecção fora da corrente sanguínea, com disseminação do sangue por meio dos vasos linfáticos. As causas da bacteremia intermitente incluem infecções envolvendo a pele, tecidos moles, ossos, articulações, pulmões, trato gastrointestinal, trato geniturinário e sistema nervoso central. Além disso, a bacteremia intermitente pode ocorrer após manipulação de tecidos infectados (como drenagem cirúrgica de abscesso) ou após instrumentação de superfícies mucosas (como tratamento dentário ou procedimentos envolvendo os tratos respiratório, geniturinário ou gastrointestinal).
A bacteremia contínua geralmente reflete a presença de um foco endovascular persistente de infecção, como endocardite infeciciosa, tromboflebite supurativa, um aneurisma infectado ou infecção de um corpo estranho intravascular, como um cateter intravascular ou enxerto vascular. Além disso, a bacteremia contínua ocorre durante as primeiras duas semanas de infecção devido à febre tifóide e brucelose; nessas condições, um número relativamente baixo de bactérias está presente no sangue.
Hemoculturas - Indicações e Coleta
Indicações
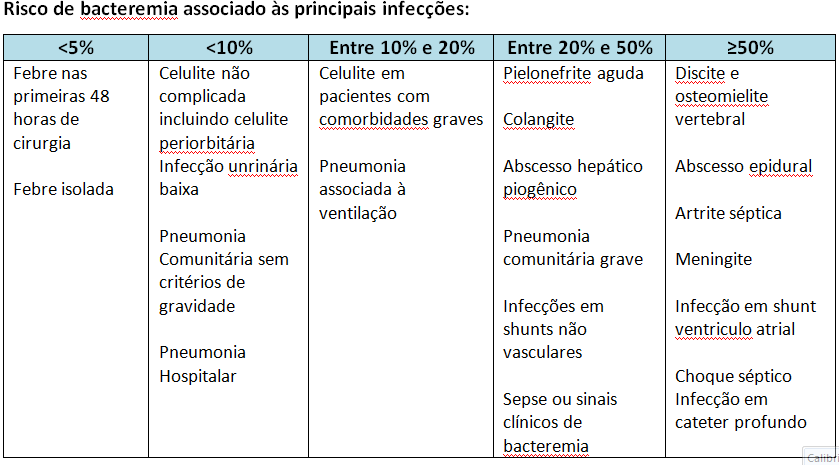
1 – Pacientes com síndromes associadas a uma elevada probabilidade de bacteremia, como:
a – Sepse
b – Suspeita de infecções endovasculares:
Endocardite infecciosa (IE)
Infecção em marcapasso/cardioversor implantável (CDI)
Infecção em cateteres intravasculares
Infecção em enxerto vascular
Tromboflebite séptica
c – Osteomielite e/ou discite
d – Meningite
e – Abscesso Epidural
f – Artrite séptica
2 – Pacientes com síndromes associadas com probabilidade moderada de bacteremia, principalmente quando as culturas da fonte primária de infecção não estão disponíveis antes do início dos antibióticos ou há duvida diagnóstica, como:
Pielonefrite
Colangite
Abcesso hepático piogênico
Pneumonia grave
Pneumonia associada à ventilação mecânica
Infecção por shunt ventriculoperitoneal
Celulite em imunossuprimidos
3 – Pacientes com infecções passiveis de apresentar bacteremia mesmo que intermitente, mas que estejam em risco de infecção endovascular, por exemplo: portadores de marcapasso, enxerto vascular, válvula protética, história de endocardite infecciosa, receptor de transplante cardíaco com valvulopatia, doença cardíaca congênita com shunt.
As hemoculturas também são freqüentemente colhidas em pacientes com febre e leucocitose ou leucopenia persistentes, quanto estes não tem sinais clínicos quem permitam clarificá-los em uma síndrome específica.
Momento e Técnica da Coleta:
As hemoculturas devem ser obtidas preferencialmente antes de iniciar a terapia antimicrobiana. O momento ideal para a coleta de hemoculturas é pouco antes do início da febre; uma vez que não é possível prever isso, é prática comum fazer hemoculturas quando a febre é detectada. No entanto, a febre no momento da coleta de hemocultura não é um indicador sensível nem específico de bacteremia.
Idealmente, as hemoculturas devem ser obtidas por profissionais com treinamento em coleta de hemocultura.
Um torniquete deve ser aplicado e a veia deve ser palpada antes da desinfecção do local da punção venosa.
O local da punção venosa deve ser desinfetado com clorexidina alcoólica a 2%.
Os septos dos frascos de hemocultura devem ser desinfetados com álcool a 70%.
Tanto o desinfetante de pele quanto o álcool usado para desinfetar os frascos de hemocultura devem secar por 30 a 60 segundos antes da inoculação.
Se a palpação da veia for necessária após a preparação da pele, uma luva estéril deve ser usada.
O sangue coletado deve ser inoculado diretamente nos frascos de cultura durante o procedimento de punção venosa.
IMPORTANTE
O volume coletado deve ser de 20mL (02 frascos de aeróbio) por sítio de punção. O HBDF não realiza culturas de rotina para anaeróbios. Caso se colha frasco de anaeróbio e o sangue seja coletado com um aparelho de agulha tipo “scalp”, o frasco aeróbio deve ser inoculado primeiro, pois o ar que fica no circuito do scalp pode tornar inviável o crescimento de anaeróbios.
Se o sangue for coletado com uma seringa e agulha o frasco anaeróbio deve ser inoculado primeiro, sem trocar a agulha entre os frascos. Se o volume for insuficiente para inocular ambos os frascos, toda a amostra deve ser inoculada no frasco aeróbio.
Caso o sangue para cultura tenha sido obtido por meio de um cateter intravenoso, a entrada da linha deverá ser cuidadosamente desinfetada com clorexidina alcoólica a 2%. Na hipótese de um cateter multilúmen, o sangue deve ser obtido através de todos os hubs do cateter. Além disso, um segundo conjunto de hemoculturas deve ser obtido por punção venosa periférica e os frascos devem ser rotulados com incluindo os locais e horários de cada coleta para análise do tempo diferencial de crescimento (discutido adiante).
Quantos Frascos Devo Coletar?
Um total de dois conjuntos de hemocultura (dois sítios diferentes) é geralmente adequado quando há suspeita de bacteremia contínua e a probabilidade pré-teste de bacteremia é alta (como em pacientes com suspeita de Endocardite Infecciosa que não receberam terapia antimicrobiana anterior).
Um total de três conjuntos de hemocultura (trêss sítios diferentes) é apropriado para circunstâncias nas quais a probabilidade pré-teste de bacteremia é baixa a moderada, mas a identificação dos patógenos é importante, por exemplo, na sepse abdominal complicada, com coleta da terceira hemocultura quatro a seis horas depois.
Um total de quatro conjuntos de hemocultura (quatro sítios diferentes) raramente é necessário; a coleta pode ser considerada quando a probabilidade pré-teste de bacteremia é alta e o patógeno previsto provavelmente é um contaminante comum, como estafilococos coagulase-negativos, porque nesse caso o crescimento em várias amostras sugere infecção no lugar de contaminação, do contrário, quanto mais amostras negativas contrapondo uma única amostra positiva, maior a possibilidade de contaminação de coleta.
Outra situação que às vezes torna necessário aumentar o número de amostras de hemocultura é diagnosticar endocardite em pacientes que receberam terapia antimicrobiana nas duas semanas anteriores.
Hemoculturas - Interpretação e Seguimento
As informações pertinentes para avaliar a significância de um resultado positivo de hemocultura incluem:
1 – O número de culturas positivas x número de amostras colhidas
O crescimento em apenas uma amostra de hemocultura sugere contaminação, desde que não seja uma bactéria tipicamente envolvida e que a clínicaNsão seja compatível de infecção de corrente sanguínea.
2 – Os organismos recuperados
2.1-Considerar clinicamente significativa:
S. aureus
Streptococcus pneumoniae
Estreptococo do grupo A
Enterobacteriaceae
Haemophilus influenzae
Pseudomonas aeruginosa
Espécies de Cândida
2.2-Pode ser clinicamente significativa ou pode refletir contaminação; sendo importante a avaliação individual de cada caso de acordo com a clínica:
Enterococos
Estreptococos Viridans
2.3-Geralmente considerados contaminantes de hemocultura. Em algumas circunstâncias, no entanto, essas bactérias podem ser clinicamente significativas; assim, a correlação clínica é necessária para estabelecer a significância:
Estafilococos coagulase negativa (principalmente se em amostra isolada)
Espécies de Corynebacterium (também conhecidas como ‘difteróides’)
C. (anteriormente Propionibacterium) acnes
Espécies de Bacillus
Espécies de Micrococcus
3 – O período de tempo para que as hemoculturas se tornem positivas
Quanto menor o tempo para positivação maior o inóculo inicial e, portanto maior a chance de se tratar de um verdadeiro positivo.
4 – O local de coleta da cultura (por exemplo, punção venosa versus cateter)
Quando há crescimento nos dois sítios e no cateter a positivação ocorre pelo menos duas horas antes do periférico sugere-se infecção a partir do cateter, por isso a importância de ter o local e horário do sítio da coleta.
IMPORTANTE
Ao final, o mais importante é avaliar o resultado da hemocultura associado à avaliação clínica global do paciente, sendo esta a informação de maior valor discriminativo para tomada de decisão terapêutica.
Hemoculturas de Seguimento ou Controle
Quando a hemocultura inicial é positiva pode ser necessário repeti-la em intervalos regulares, dentro de um a dois dias após o início da terapia antimicrobiana, para avaliação da efetividade da terapia e planejamento do tempo total de tratamento. As principais condições onde uma hemocultura inicial POSITIVA pode ser repetida são em até 72 horas são:
a-Bacteremia devido a S. aureus ou lugdunensis
b-Presença de infecção endovascular conhecida ou suspeita como:
Endocardite infecciosa (EI)
Infecção de cardioversor desfibrilador implantável (CDI) / marca-passo
Infecção do cateter intravascular
Infecção do enxerto vascular
Tromboflebite séptica
c-Bacteremia intermitente em paciente com risco de infecção endovascular: inclui pacientes com CDI / marca-passo, enxerto vascular, válvula protética, história de EI, receptor de transplante cardíaco com valvopatia, doença cardíaca congênita não corrigida, doença cardíaca congênita corrigida com shunt residual ou regurgitação valvar , ou doença cardíaca congênita corrigida nos primeiros seis meses após a comparação
d-Presença ou febre, leucocitose ou outros sinais de infecção mais de 72 horas após o início da terapia antimicrobiana
e-Local conhecido ou suspeito de infecção com penetração antimicrobiana limitada, como um abscesso ou infecção do espaço articular
f-Fonte presumida de infecção no abdômen ou sistema nervoso central
g-Presença de patógenos multirresistentes aos agentes antimicrobianos padrão
h-Fonte desconhecida da bacteremia inicial
Tratamento
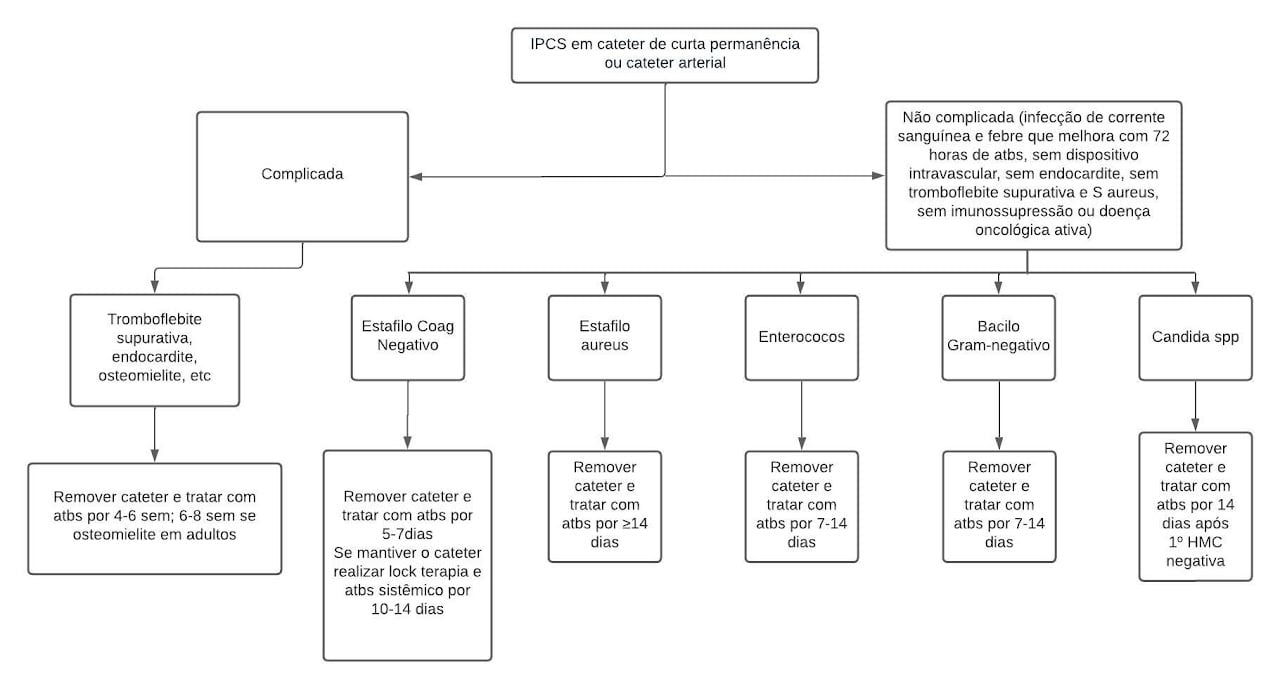
Tomada de decisão:
Coletar hemoculturas, avaliar necessidade de ecocardiograma transeofágico de acordo com a evolução clínica e risco para endocardite.
Iniciar esquema antimicrobiano empírico com:
Piperacilina/tazobactam 4,5 gEV6/6hs + Vancomicina25-30mg/kg(Ataque) + 15 mg/kg , EV,12/12hs
Opção terapêutica:
Cefepime2gEV8/8hs + Vancomicina25-30mg/kg(Ataque) + 15 mg/kg ,EV,12/12hs
Observação:
Em caso de Insuficiência renal aguda ou farmacodermia, substituir vancomicina por Daptmocina 12mg/kg/dia.
Paciente crítico internado em uso de Cateter Venoso Central há mais de 48 h, com uso prévio de antimicrobianos e sem instabilidade hemodinâmica.
Tomada de decisão:
Coletar hemoculturas, avaliar necessidade de ecocardiograma transeofágico de acordo com a evolução clínica e risco para endocardite.
Iniciar esquema antimicrobiano com:
Meropenem1g,EV,8/8hs (ataque: administração em bolus e manutenção em infusão estendida em 3h) + Vancomicina25-30mg/kg(Ataque) + 15 mg/kg ,EV,12/12hs
Opção terapêutica:
Meropenem1g,EV,8/8hs (ataque: administração em bolus e manutenção em infusão estendida em 3h) + Daptmocina 12mg/kg/dia em caso de insuficiência renal aguda ou hipersencibilidade à vancomicina
Paciente crítico internado em uso de Cateter Venoso Central há mais de 48 h, com uso prévio de antimicrobianos ou colonização por MDR, com instabilidade hemodinâmica.
Tomada de decisão:
Coletar hemoculturas, solicitar ecocardiograma transeofágico.
Iniciar esquema antimicrobiano com:
Meropenem2 g,EV,8/8hs (ataque: administração em bolus e manutenção em infusão estendida em 3h) + Vancomicina25-35mg/kg(Ataque) +15 mg/kg ,EV,12/12hs
Opção terapêutica:
Meropenem2g,EV,8/8hs (ataque: administração em bolus e manutenção em infusão estendida em 3h) +Daptmocina 12mg/kg/dia em caso de insuficiência renal aguda
Observação:
Conforme avaliação da equipe assistente e/ou discussão com o Núcleo de Controle de Infecção, associar amicacina 15-20mg/kg/dia.
Bibliografia
- Doern GV, Carroll KC, Diekema DJ, et al. Practical Guidance for Clinical Microbiology Laboratories: A Comprehensive Update on the Problem of Blood Culture Contamination and a Discussion of Methods for Addressing the Problem. Clin Microbiol Rev 2019; 33.
- Fabre V, Sharara SL, Salinas AB, et al. Does This Patient Need Blood Cultures? A Scoping Review of Indications for Blood Cultures in Adult Nonneutropenic Inpatients. Clin Infect Dis 2020; 71:1339.
- Riedel S, Carroll KC. Blood cultures: key elements for best practices and future directions. J Infect Chemother 2010; 16:301.
- Magadia RR, Weinstein MP. Laboratory diagnosis of bacteremia and fungemia. Infect Dis Clin North Am 2001; 15:1009.
- Garcia RA, Spitzer ED, Beaudry J, et al. Multidisciplinary team review of best practices for collection and handling of blood cultures to determine effective interventions for increasing the yield of true-positive bacteremias, reducing contamination, and eliminating false-positive central line-associated bloodstream infections. Am J Infect Control 2015; 43:1222.
- Coburn B, Morris AM, Tomlinson G, Detsky AS. Does this adult patient with suspected bacteremia require blood cultures? JAMA 2012; 308:502.
- Seigel TA, Cocchi MN, Salciccioli J, et al. Inadequacy of temperature and white blood cell count in predicting bacteremia in patients with suspected infection. J Emerg Med 2012; 42:254.
- Fu CM, Tseng WP, Chiang WC, et al. Occult Staphylococcus aureus bacteremia in adult emergency department patients: rare but important. Clin Infect Dis 2012; 54:1536.
- Cheng MP, Stenstrom R, Paquette K, et al. Blood Culture Results Before and After Antimicrobial Administration in Patients With Severe Manifestations of Sepsis: A Diagnostic Study. Ann Intern Med 2019; 171:547.
- Snyder SR, Favoretto AM, Baetz RA, et al. Effectiveness of practices to reduce blood culture contamination: a Laboratory Medicine Best Practices systematic review and meta-analysis. Clin Biochem 2012; 45:999.
- Emergency Nurses Association 2016: Clinical practice guideline: prevention of blood culture contamination. https://www.ena.org/docs/default-source/resource-library/practice-resources/cpg/bcccpg2c37f1815b664d2fa8d7e9fd0f475a41.pdf?sfvrsn=6d1899fb_12.
- Caldeira D, David C, Sampaio C. Skin antiseptics in venous puncture-site disinfection for prevention of blood culture contamination: systematic review with meta-analysis. J Hosp Infect 2011; 77:223.
- Clinical and laboratory Standards Institute (CLSI). Principles and procedures for blood cultures: approved guideline. CLSI document M47-A. Wayne (PA): Clinical and Laboratory Standards Institute; 2007.
- Kim NH, Kim M, Lee S, et al. Effect of routine sterile gloving on contamination rates in blood culture: a cluster randomized trial. Ann Intern Med 2011; 154:145.
- Guembe M, Rodríguez-Créixems M, Sánchez-Carrillo C, et al. How many lumens should be cultured in the conservative diagnosis of catheter-related bloodstream infections? Clin Infect Dis 2010; 50:1575.
- Zimmerman FS, Karameh H, Ben-Chetrit E, et al. Modification of Blood Test Draw Order to Reduce Blood Culture Contamination: A Randomized Clinical Trial. Clin Infect Dis 2020; 71:1215.
- Patel R, Vetter EA, Harmsen WS, et al. Optimized pathogen detection with 30- compared to 20-milliliter blood culture draws. J Clin Microbiol 2011; 49:4047.
- Ilstrup DM, Washington JA 2nd. The importance of volume of blood cultured in the detection of bacteremia and fungemia. Diagn Microbiol Infect Dis 1983; 1:107.
- Mermel LA, Maki DG. Detection of bacteremia in adults: consequences of culturing an inadequate volume of blood. Ann Intern Med 1993; 119:270.
- Miller JM, Binnicker MJ, Campbell S, et al. A Guide to Utilization of the Microbiology Laboratory for Diagnosis of Infectious Diseases: 2018 Update by the Infectious Diseases Society of America and the American Society for Microbiology. Clin Infect Dis 2018; 67:e1.
- Lee A, Mirrett S, Reller LB, Weinstein MP. Detection of bloodstream infections in adults: how many blood cultures are needed? J Clin Microbiol 2007; 45:3546.
- Tafuro P, Colbourn D, Gurevich I, et al. Comparison of blood cultures obtained simultaneously by venepuncture and from vascular lines. J Hosp Infect 1986; 7:283.
- Riedel S, Bourbeau P, Swartz B, et al. Timing of specimen collection for blood cultures from febrile patients with bacteremia. J Clin Microbiol 2008; 46:1381.
- Karen C. Carroll, Melvin P. Weinstein. Manual and Automated Systems for Detection and Identification of Microorganisms. In: Manual of Clinical Microbiology, 9th, Patrick R. Murray (Ed), ASM Press, Washington, D.C. 2007. p.192.
- Box MJ, Sullivan EL, Ortwine KN, et al. Outcomes of rapid identification for gram-positive bacteremia in combination with antibiotic stewardship at a community-based hospital system. Pharmacotherapy 2015; 35:269.
- Lamy B, Dargère S, Arendrup MC, et al. How to Optimize the Use of Blood Cultures for the Diagnosis of Bloodstream Infections? A State-of-the Art. Front Microbiol 2016; 7:697.
- Pien BC, Sundaram P, Raoof N, et al. The clinical and prognostic importance of positive blood cultures in adults. Am J Med 2010; 123:819.
- Beekmann SE, Diekema DJ, Doern GV. Determining the clinical significance of coagulase-negative staphylococci isolated from blood cultures. Infect Control Hosp Epidemiol 2005; 26:559.
- Richter SS, Beekmann SE, Croco JL, et al. Minimizing the workup of blood culture contaminants: implementation and evaluation of a laboratory-based algorithm. J Clin Microbiol 2002; 40:2437.
- Mermel LA, Allon M, Bouza E, Craven DE, Flynn P, O’Grady NP, Raad II, Rijnders BJ, Sherertz RJ, Warren DK. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2009 Jul 1;49(1):1-45. doi: 10.1086/599376. Erratum in: Clin Infect Dis. 2010 Apr 1;50(7):1079. Dosage error in article text. Erratum in: Clin Infect Dis. 2010 Feb 1;50(3):457. PMID: 19489710; PMCID: PMC4039170.
